Par le Dr Cécile Damoiseaux, spécialiste (Dip ECVIM-option cardio), service de cardiologie du CHV Frégis
Prise en charge par thermoablation échoguidée par microondes d’un chémodectome chez un Bouledogue français.
Un chien bouledogue mâle castré de 10 ans est présenté en urgence pour épanchement tri-cavitaire: péricardique (avec tamponnade cardiaque), pleural et abdominal. Une péricardiocentèse d’urgence est réalisée et révèle un hémopéricarde. L’épanchement pleural et abdominal est un transudat modifié avec une analyse cytologique du liquide peu remarquable. L’échocardiographie met en évidence une masse tissulaire cardiaque circulaire d’échogénicité homogène prenant insertion sur la crosse aortique, de 2,5 sur 3,5 cm de diamètre. Compte tenu de la conformation raciale de l’animal (brachycéphale) et de la localisation de la masse, un chémodectome est suspecté en premier lieu. Néanmoins, un autre type tumoral ne peut à ce stade être exclu sans réaliser de biopsies.
Les chémodectomes font partie des trois tumeurs cardiaques les plus fréquemment identifiées chez le chien. Elle prennent leur origine à partir des cellules des chémorécepteurs et sont fréquemment localement invasives. La présentation clinique du chien est très variable, pouvant aller de l’absence de signes cliniques (découverte fortuite lors d’un examen échocardiographique) à un état critique (lors de tamponnade cardiaque) en passant par une dysfonction des structures cardiaques adjacentes.
L’approche thérapeutique pour ce type de tumeur inclus 1) la chirurgie palliative (péricardectomie subtotale ou partielle ou l’exérèse de la masse), 2) la radiothérapie conformationnelle en 3 dimensions, 3) la chimiothérapie (tocéranib) et enfin 4) la thermoablation échoguidée par radiofréquence ou microondes.
Prise en charge initiale par chimiothérapie
Dans notre cas, une thérapie ciblée au tocéranib (Palladia ®) est initialement décidée. Le tocéranib est un inhibiteur spécifique des tyrosines kinases qui agit en bloquant la prolifération cellulaire. Il possède une autorisation de mise sur le marché (AMM) pour le traitement des mastocytomes cutanés du chien, mais cette molécule peut être également utilisée hors AMM pour le traitement d’autres processus tumoraux. Dans deux études récentes un bénéfice clinique est observé dans 80 à 90 % des cas (rémission complète ou partielle, ou stabilisation de la masse plus de 10 semaines), avec 10% de réponse partielle (diminution de la taille de la tumeur de plus de 20%).1,2 Lors d’administration de cette molécule, une médiane de survie de 700 jours et de 500 jours est rapportée respectivement en l’absence de métastases et si des métastases sont mises en évidence.2
Ce traitement est généralement bien tolérée par les chiens. Les effets adverses rapportés incluent entre autres, des troubles digestifs (vomissements, diarrhées), une toxicité rénale (syndrome néphrotique), une toxicité hépatique, une myélosuppresion, une hypertension artérielle et des troubles cutanés et musculaires. Ainsi, pour notre cas, un suivi rapproché est réalisé incluant des bilans sanguins (biochimie sanguine et numération formule sanguine), un suivi de la pression artérielle, des analyses d’urine (mesure du rapport protéines/créatinine urinaire), et des échocardiographies tous les deux mois. Une nette amélioration clinique est notée au début de la thérapie, ainsi qu’une absence récidive d’épanchement péricardique. La taille de la masse tumorale évaluée en échocardiographie semble stable. Les contrôles sanguins révèlent néanmoins une discrète leucopénie par neutropénie de grade 1, stable au cours du suivi.
Au contrôle six mois après initiation du traitement, l’état clinique du chien se dégrade, il est algique, présente un érythème des plis labiaux, faciaux et interdigités et une aggravation de la leucopénie par neutropénie, suggérant une hématotoxocité secondaire à la thérapie ciblée. A l’échocardiographie, un épanchement péricardique est de nouveau mis en évidence et la masse visualisée a augmenté de taille (5,2 cm x 3,5 cm). De ce fait, la poursuite du traitement au tocéranib n’est pas indiquée.
Prise en charge chirurgicale par péricardectomie
En raison de la récidive d’épanchement péricardique, la réalisation d’une péricardectomie est décidée. Cette intervention consiste en l’exérèse chirurgicale partielle ou totale du péricarde supprimant ainsi les risques liés à une tamponnade cardiaque. Dans une étude, une médiane de survie comprise entre 600 à 700 jours est rapportée avec péricardectomie versus moins de deux mois sans.3
Pour notre cas, une péricardectomie est réalisée et un fragment de péricarde est prélevé pour analyse. L’analyse histologique met en évidence une péricardite chronique lymphocytaire, d’intensité subnormale et de répartition multifocale, associée à une fibrose irrégulière et enrichie de rares granulocytes neutrophiles. L’état général du chien post-péricardectomie est bon.
Prise en charge par thermoablation
La péricardectomie ne permet néanmoins pas d’arrêter la progression du chémodectome et afin de retarder une telle évolution, une thermoablation échoguidée par microonde est proposée et acceptée par les propriétaires. Cette technique, innovante, considérée comme peu invasive, a pour but d’agir directement sur la tumeur en induisant une réduction de la masse tumorale par nécrose de coagulation. En médecine humaine, l’efficacité de cette technique est rapportée pour plusieurs types de tumeurs primaires et métastases, avec une amélioration de la taille de la masse corrélée à un contrôle de l’activité de la tumeur mais n’est pas utilisée pour les tumeurs cardiaques. Actuellement, cette technique est peu utilisée en médecine vétérinaire, bien qu’elle ait montré des résultats encourageant pour le traitement de masse thyroïdiennes et parathyroïdiennes chez des chiens.4,5 A notre connaissance, aucun cas de thermoablation échoguidée par microonde n’a été décrit pour le traitement d’un chémodectome.
Une étude rétrospective récente de thermoablation mais par radiofréquence réalisée sur cinq chiens témoigne d’une réelle efficacité d’une telle intervention puisqu’elle a permis une réduction d’au moins 50% du volume tumoral de l’ensemble des chiens six mois après l’intervention.6 Néanmoins, l’étude souligne le fait qu’en cas de tumeur supérieure à 5 cm, le risque d’échec est d’environ 20%, nécessitant la répétition de la procédure. Les risques rapportés liés à cette intervention incluent des arythmies cardiaques, une nécrose thermique du myocarde ou structures adjacentes et des saignements.
La procédure se déroule sous anesthésie générale sous conditions d’asepsie strictes et par voie échoguidée. Une sonde transmet des microondes qui génèrent de la chaleur provoquant une nécrose par coagulation. (Figure 1) Dans notre cas, la procédure s’est déroulée sans complication et une hospitalisation avec surveillance du chien 24 heures a été décidée.
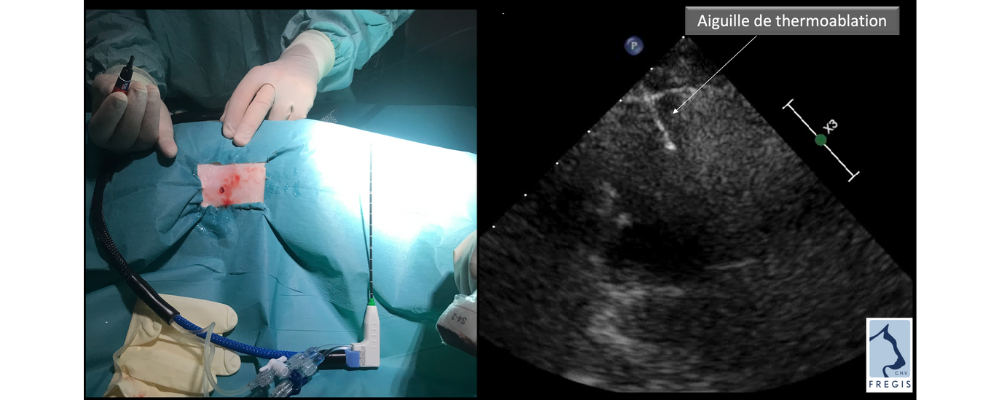
Figure 1 : Sonde transmettant des microondes qui génèrent de la chaleur provoquant une nécrose par coagulation.
Suivis
Au contrôle clinique un mois post-procédure, l’animal présente un très bon état général avec absence totale de signe clinique. Le suivi d’imagerie est encourageant : l’échocardiographie montre une diminution du volume tumoral estimée à 20% associée à un remaniement visible du tissu tumoral (zones de nécroses). En se basant sur l’étude réalisée par radiofréquence6 , les résultats définitifs sont observés à 6 mois post-intervention. Dans notre cas, le suivi à 5 mois post thermoablation montre une diminution du diamètre tumoral estimée à plus de 50% dans le grand axe de la tumeur toujours associée à un remaniement du tissu. (Figure 2) L’état général de l’animal est très bon avec absence totale de signe clinique rapporté par les propriétaires. Des suivis réguliers sont planifiés dans le futur.
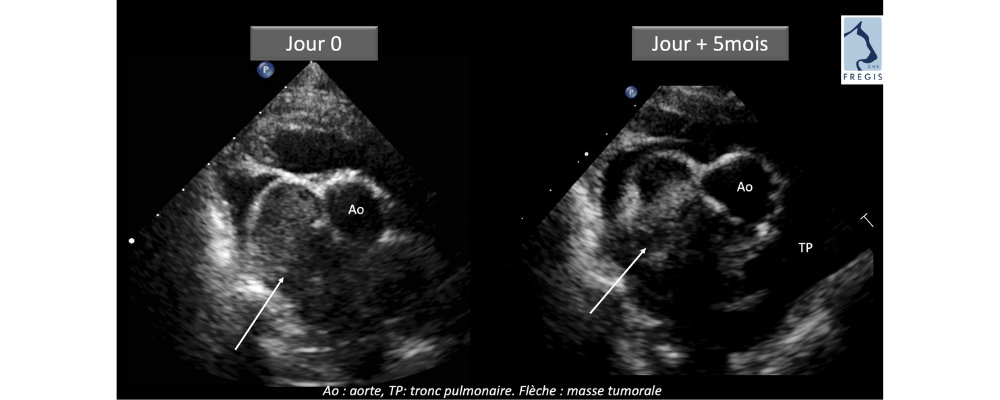
Figure 2 : Suivi à 5 mois post thermoablation
Bibliographie :
(1) Coto G M , Musser M L, Tropf M A et coll. A multi-institutional retrospective analysis of toceranib phosphate for presumed or confirmed canine aortic body chemodectomas. Front Vet Sci. 2021, 8, 635057.
(2) Lew FH, McQuown B, Borrego J et coll. Retrospective evaluation of canine heart base
tumors treated with toceranib phosphate (Palladia®) : 2011–2018. Vet Comp Oncol. 2019, 17:465–71.
(3) Vicari, E D , Brown D C, Holt D E. et coll. , & Brockman, D. J. Survival times of and prognostic indicators for dogs with heart base masses: 25 cases (1986–1999). J Am Vet
Med Assoc. 2001, 219 (4), 485-487
(4) Pollard R E, Long C D, Nelson R W et coll. Percutaneous ultrasonographically guided radiofrequency heat ablation for treatment of primary hyperparathyroidism in dogs. J Am Vet Med Assoc. 2001, 218, 1106–1110.
(5) Rasor L, Pollard R, Feldman E C. Retrospective evaluation of three treatment methods for primary hyperparathyroidism in dogs. J Am Anim Hosp Assoc. 2007, 43, 70–77.
(6) Gómez Ochoa P, Alférez, M D , de Blas I et coll. Ultrasound-Guided Radiofrequency
Ablation of Chemodectomas in Five Dogs. Animals. 2021. 11 (10), 2790.